L'impression 3D de médicaments L'impression 3D de médicaments
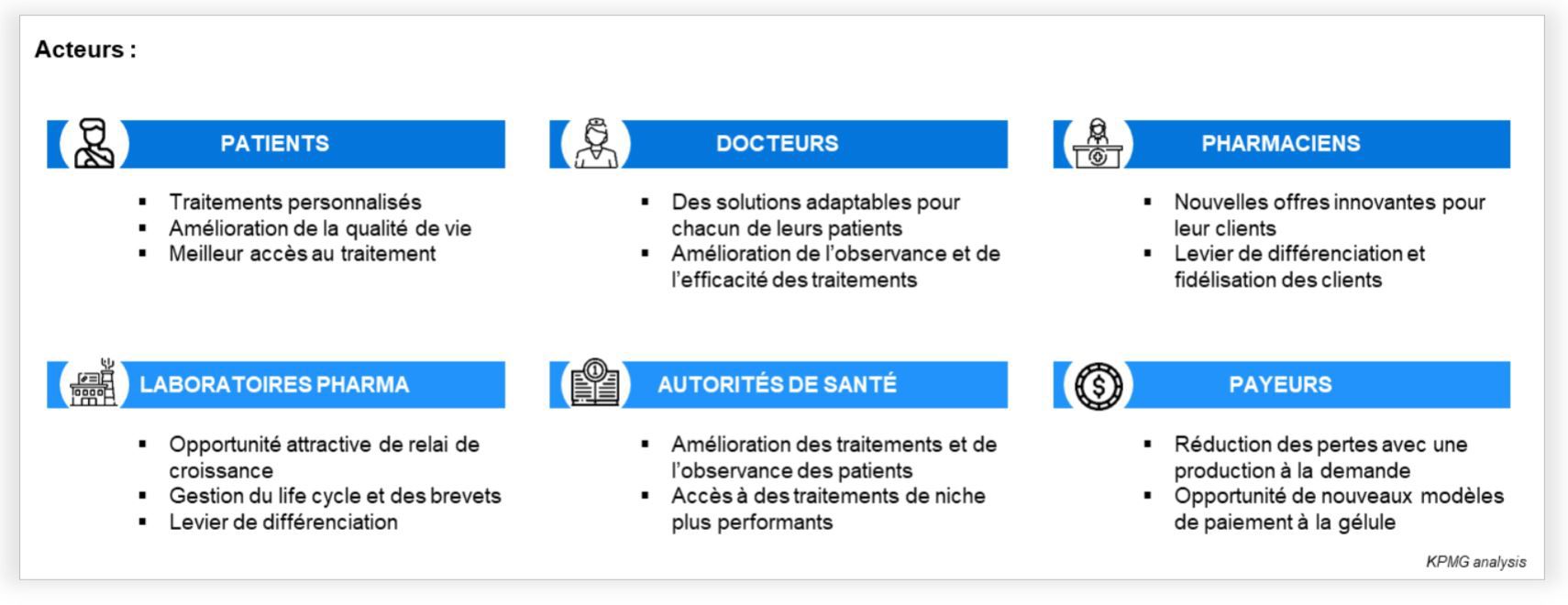
L’impression 3D dans l’univers de la santé n’en est plus à ces débuts : bio impressions, prothèses, implants, équipements, sont à des stades avancés de développement. Les avantages de cette technologie pour les patients (ultra personnalisation) et les professionnels de santé (production sur site, à la demande et à bas coût), en font un levier efficace pour répondre aux enjeux du secteur dans les années à venir.
Avec la COVID, l’impression 3D a d’ailleurs bénéficié d’une mise en avant toute particulière. En démontrant la vulnérabilité de notre système de soin et le manque de réactivité de certaines chaînes d’approvisionnement, elle a permis à l’impression 3D de se positionner comme une alternative crédible et innovante pour faire face aux tensions exercées sur l’ensemble du secteur.
L’impression 3D est donc en phase de devenir une réalité dans bien des hôpitaux du monde, mais il en est autrement pour l’impression 3D de médicaments. En effet, cette technologie permettant d’imprimer des comprimés à partir d’une matière première (poudre, filament ou encre) contenant principe actif et excipient, reste aujourd’hui encore peu développée mais attise les intérêts (notamment pour des besoins de personnalisation des traitements).
A ce jour, le Spritam reste le seul médicament dont la production en 3D a été autorisée par une agence de santé (par la FDA en 2017). Produit par le laboratoire Aprecia Pharmaceuticals, grâce à la technique de collage de poudre par jet d’encre, cette initiative a permis au laboratoire de breveter une technologie « ZipDose » et de la proposer ainsi en sous-traitance pour d’autres acteurs de l’industrie.
Malgré une empreinte encore faible sur le marché, ce champ d’application de la 3D, est très prometteur : les opportunités sont multiples et les bénéfices réels pour les patients et l’ensemble des professionnels de santé.
Exemple d’impression 3D de médicaments avec FabRx
Source : FabRx

La technologie et le champ de connaissance s’étendent rapidement
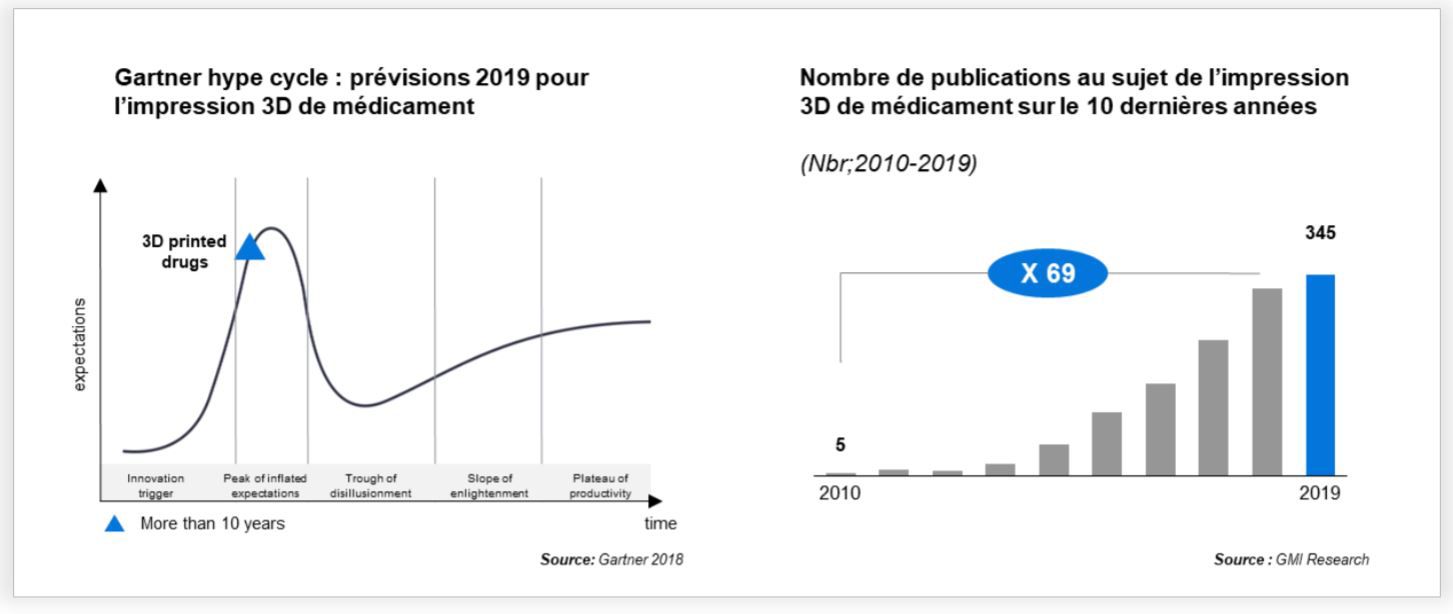
Si l’intérêt pour l’impression 3D de médicaments n’est pas nouveau, sa maturité et son application économique ont longtemps paru lointaines. Positionnée en haut de la courbe de Gartner (2018) avec un haut potentiel, son application à l’échelle trouve un horizon à 10 ans.
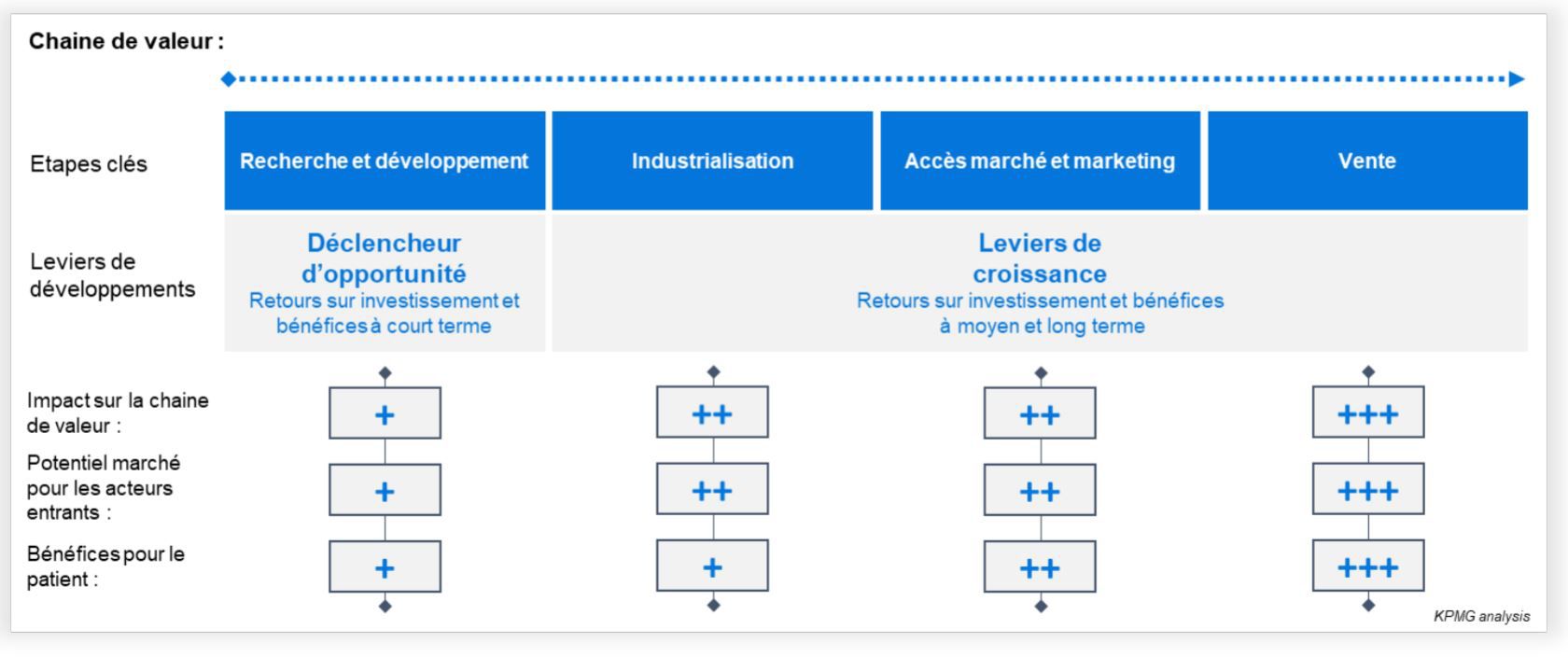
Cela s’explique facilement par la complexité et le niveau de maîtrise que requiert le développement d’une telle technologie avant d’imaginer son déploiement à l’échelle sur le marché. La maîtrise des technologies d’impression 3D (FDM, SLS, SLA, Jet d’encre), le développement de la matière première (principe actif et excipient sous forme de poudre, de filament, ou d’encre), la sécurisation d’une solution pouvant être approuvée par les agences de santé, implique un travail de longue haleine.
Et, si les prédictions de croissance, de ce marché encore peu mature (CAGR 2017-2025 : 4% à 9%), restent incertaines et bien en-dessous des standards du marché de l’impression 3D dans la santé (CAGR 2018-2026 : 18,2%), cette technologie n’en demeure pas moins séduisante. En témoigne, l’explosion en 10 ans du nombre de publications liées à l’impression 3D de médicaments, montrant l’intérêt des chercheurs, mais aussi des industriels et des institutions, pour cette technologie.
La course est lancée…
Des indicateurs de maturité qui soulignent le potentiel de l’impression 3D de médicaments
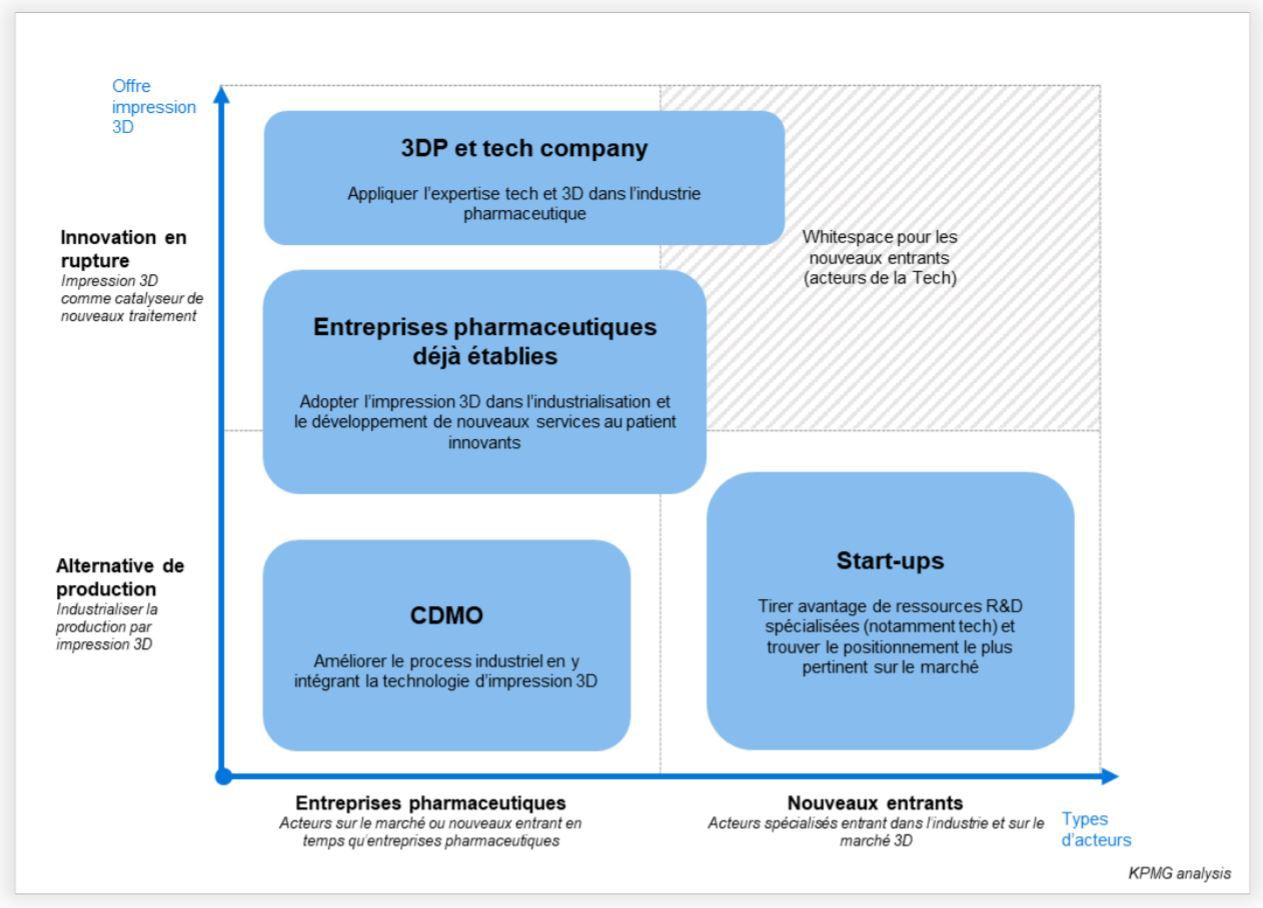
Un écosystème 3D en mouvement
Si Aprecia, avec le Spritam, a posé la première pierre en 2017 (autorisation de mise sur le marché par la FDA d’une technologie de production 3D à grande échelle), l’ensemble des possibles et bénéfices liés à cette technologie (personnalisation des traitements, mise à la dose, etc.) restent encore à explorer. Ainsi, des mouvements apparaissent et l’écosystème s’active pour se structurer autour d’une grande variété d’acteurs voyant dans cette technologie et ce marché une opportunité pour de nouveaux relais de croissance. Centres de recherche, start-ups, entreprises de la tech’, CDMO, industriels, etc. chacun d’entre eux, par son expertise et son savoir-faire, est en mesure de se positionner sur cette technologie émergente pour rendre accessible de nouveaux services et traitements innovants.